대웅제약 나보타, 유럽 판매 허가 받아
EMA 산하 CHMP로부터 ‘허가 승인 권고’ 획득
"국산 보툴리눔 톡신 최초 미국·유럽진출 기대"
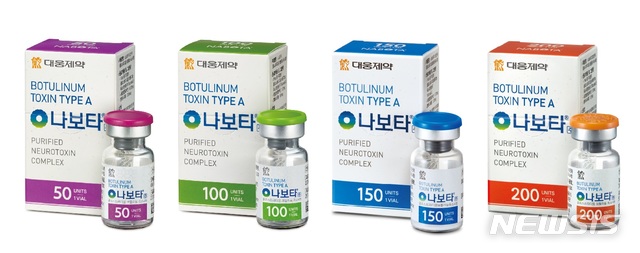
【서울=뉴시스】나보타. 2018.11.09.(사진= 대웅제약 제공) [email protected]
대웅제약은 26일(현지시간) EMA 산하 CHMP로부터 나보타(유럽제품명 누시바)의 미간주름 적응증(사용범위)에 대해 '허가승인 권고' 의견을 받았다고 밝혔다. 지난 2017년 7월 EMA에 허가를 신청한지 약 1년 9개월 만이다.
CHMP는 의약품의 유효성, 안전성 등에 대한 과학적 평가 결과를 바탕으로 허가 여부를 논의해 유럽연합 집행위원회(EC)에 의견을 제시하는 기구다.
EC는 CHMP의 권고일로부터 3개월 이내 집행위원회가 판매 허가 여부에 대해 최종으로 결정을 내린다.
대웅제약은 향후 3개월 내 최종 허가를 받으면 유럽연합 내 28개 국가와 노르웨이, 아이슬란드, 리히텐슈타인이 속한 유럽경제지역(EEA) 3개국 등 유럽 총 31개국에 나보타를 공급할 수 있게 된다.
나보타의 유럽 판권은 대웅제약 해외 파트너사인 미국 에볼루스가 보유하고 있다. 에볼루스는 하반기 유럽에서 나보타를 '누시바'란 제품명으로 출시할 계획이다.
나보타는 대웅제약이 지난 2014년 국내에 출시한 보툴리눔 톡신 제제다. 지난 2월 국산 보툴리눔 톡신 제품 중 처음으로 미국 식품의약국(FDA)으로부터 판매 허가를 받았다.
[email protected]
Copyright © NEWSIS.COM, 무단 전재 및 재배포 금지