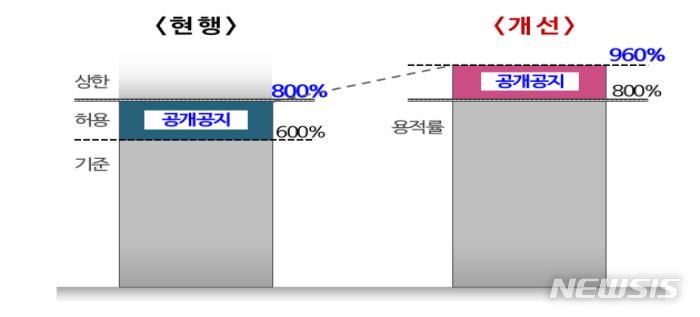
네오이뮨텍, 유럽학회서 ‘키트루다-NT-I7’ 병용 임상 포스터 공개
유럽종양학회 주관 위장관종양학회(ESMO GI) 참가
췌장암·MSS 대장암 세부 데이터 공개
네오이뮨텍은 지난달 29일부터 지난 2일까지 스페인 바르셀로나에서 진행된 유럽종양학회 주관 위장관종양학회(ESMO GI)에 참가했다. 안내하는 네오이뮨텍 관계자(왼쪽)의 모습. (사진=네오이뮨텍 제공) *재판매 및 DB 금지
【서울=뉴시스】황재희 기자 = T세포 증폭 유도 면역항암제를 개발 중인 네오이뮨텍은 지난달 29일부터 지난 2일까지 스페인 바르셀로나에서 진행된 유럽종양학회 주관 위장관종양학회(ESMO GI)에서 ‘NIT-110’ 2a임상 중 췌장암(26명)과 MSS대장암(27명) 중간 결과 포스터 2건을 공개했다고 4일 밝혔다.
췌장암에서 네오이뮨텍 T세포 증폭제 ‘NT-I7’과 면역항암제 키트루다를 병용한 결과, 면역항암제 반응평가기준인 iRECIST 기준 암 크기가 기존 대비 30% 이상 줄어든 환자(iORR, 객관적 반응률)는 7.7%, 반응지속기간은 7.2개월로 나타났다. 암 크기에 큰 변화 없이 진행이 통제되고 있는 환자(질병통제율)는 34.6%로 조사됐다.
이 중 간 전이가 한 군데 이하인 환자들의 질병통제율은 63.6%, 무진행 생존기간 중앙값은 18주에 달했다.
MSS 대장암의 경우, iRECIST 기준 객관적 반응률은 11.1%였고, 반응지속기간은 6.7개월로 최근 6월 미국임상종양학회(ASCO)에서 발표했던 데이터 대비 약 2개월 증가했다. 질병통제율은 40.7%였다.
네오이뮨텍 관계자는 “전이성 대장암 85%를 차지하는 MSS 대장암은 아직 허가 받은 면역항암제가 없는 상황”이라며 “머크에서 키트루다 단독 요법을 시도했으나 객관적 반응률 0%, 질병통제율 11%로, 적응증 승인에 고배를 마신 바 있다”고 말했다.
이어 “MSS 대장암과 췌장암은 네오이뮨텍의 다양한 임상 중 신약 승인 가능성이 큰 적응증으로 꼽힌다”며 “1b/2a상으로 안전성과 항암 효과를 확인한 만큼 머크와 면밀하게 향후 계획 논의를 이어가고, 올해 중 총 50명의 환자(MSS 대장암, 췌장암 각각 25명)를 추가 모집해 추가 안전성과 효능 데이터를 확보, 후속 임상 진입에 활용할 계획”이라고 설명했다.
양세환 네오이뮨텍 대표이사는 “항암제 승인 핵심 요인은 결국 전체 생존 기간으로, 증폭된 T세포가 항암효과를 지속시켜주는 NT-I7 특성이 환자 생존 기간 연장에 기여할 것으로 기대되고 있다”며 “추가 환자에 대한 임상 결과가 준비되는 대로 글로벌 학회에서 이를 공개하고, 올해 연말 혹은 내년 초에 상업화를 위한 전략을 수립해 공개할 예정”이라고 말했다.
◎공감언론 뉴시스 [email protected]
Copyright © NEWSIS.COM, 무단 전재 및 재배포 금지