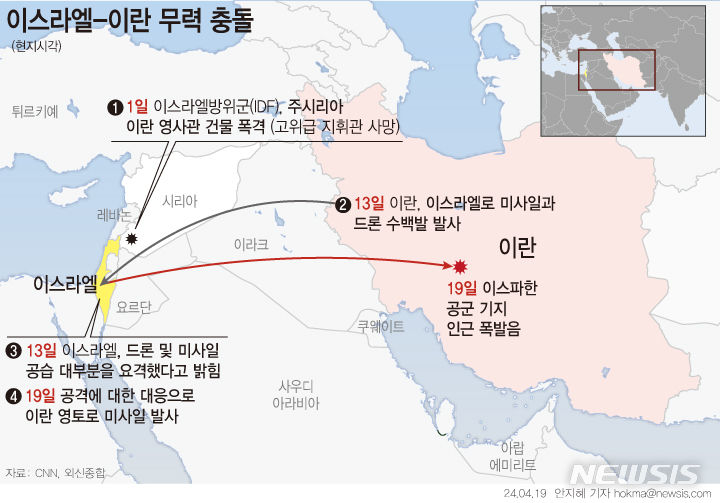
에이치엘비생명과학, 위암 1차 치료제로…국내 임상3상 추진

[서울=뉴시스] 이승주 기자 = 에이치엘비생명과학(067630)이 리보세라닙과 캄렐리주맙, 세포독성항암제를 병용요법으로 위암 1차 치료제로 개발하기 위해 국내 임상 3상을 추진한다고 19일 밝혔다.
에이치엘비생명과학은 이날 진행성이나 전이성 위암과 위식도접합부암 환자를 대상으로 리보세라닙 병용요법을 1차 치료제로 개발하기 위한 임상시험계획(IND)을 한국 식약처에 제출했다고 공시했다.
리보세라닙은 에이치엘비가 글로벌 권리를 보유한 표적 항암신약 물질이다. 에이치엘비생명과학이 국내 판권을 갖고 있다. 캄렐리주맙은 중국 항서제약이 개발한 면역관문억제제(PD-1저해)다.
이번 임상은 이전 치료력이 없는 위암 환자 총 885명을 대상으로 진행된다. 이번 임상은 다국가 임상시험으로 중국에서는 항서제약이, 국내에서는 에이치엘비생명과학이 IND holder(임상시험 의뢰자)로 진행하게 된다. 에이치엘비생명과학은 다만 식약처의 임상승인이 지체되면 항서제약과 협의에 의해 임상진행 여부를 재결정할 수 있다고 밝혔다.
에이치엘비생명과학 관계자는 "계획대로 식약처 승인을 받아 본격적으로 임상시험에 돌입하면 리보세라닙의 위암에 대한 적응증이 다양해지면서 기업가치가 높아질 것"으로 기대했다.
리보세라닙은 현재 에이치엘비가 말기 위암에 대해 미 FDA에 NDA(기밀유지협약) 제출을 준비 중에 있다. 위암 2차 치료제로 파클리탁셀과 병용임상 2상도 진행하고 있다.
◎공감언론 뉴시스 [email protected]
Copyright © NEWSIS.COM, 무단 전재 및 재배포 금지