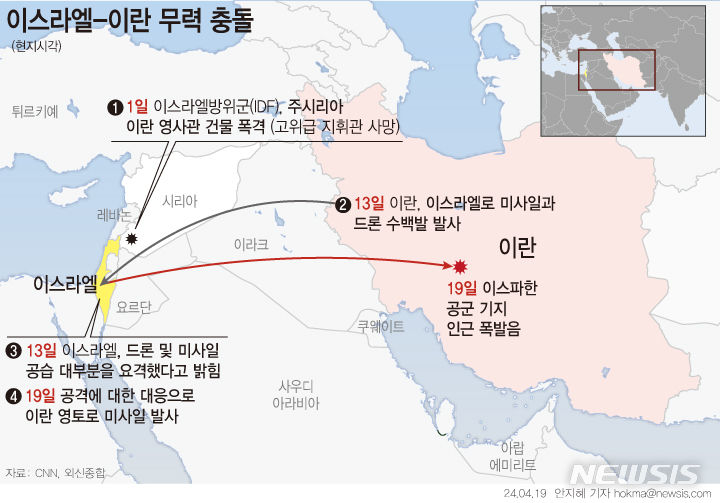
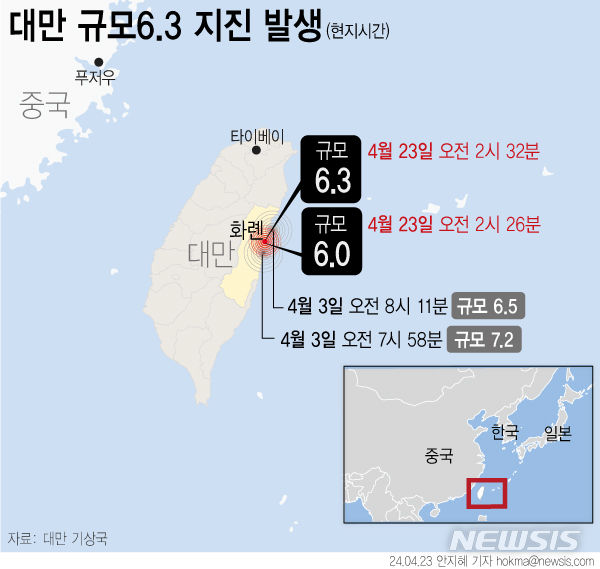
한국파마, '제넨셀 코로나19 경구용 치료제' 국내 임상 IND 승인
제넨셀 측 유럽 임상시험 진입도 준비 박차

27일 한국파마에 따르면 회사는 올해 초 제넨셀과 코로나19 치료제 및 대상포진 치료제 개발·생산에 대한 업무협약(MOU)을 맺고 전략적 투자를 진행한 바 있다.
제넨셀의 코로나19 치료제 'ES16001'은 천연물 유래 성분으로 코로나19 경증 및 중등도 환자를 대상으로 진행된 인도 임상2상에서 투약 6일만에 95% 이상의 환자가 회복되는 치료 효과를 확인한 바 있다. 이번 국내 임상2·3상 진입을 통해 초기 코로나19 환자를 대상으로 중증 이행을 막아 입원율과 사망률 감소 확인과 무증상 상태에서 치료 효과를 확인할 예정이다.
제넨셀 관계자는 "이번 IND 승인은 유럽 연합을 중심으로 추진 중인 ES16001의 글로벌 임상의 초석"이라면서 "한국, 인도, 유럽 3개국 등 5개 국가에서 실시되는 대규모 시험으로 유효성을 검증할 계획"이라고 말했다.
이어 "머크(MSD)의 코로나19 경구용 치료제 '몰누피라비르'와 회사의 치료제는 코로나19 바이러스의 복제를 막는다는 점에서 유사하지만 뉴클레오사이드 유사체인 몰누피라비르는 바이러스의 리보핵산(RNA) 서열 오류를 통해 사멸을 유도한다는 점에서 차이가 있다"면서 "또 ES16001은 천연물 신약으로 장기 복용이 가능한 우수한 약물 안전성과 약가적인 측면에서 경쟁력이 있을 것"이라고 설명했다.
한국파마는 이번 코로나19 치료제의 국내 임상2·3상과 연이어 예정된 유럽·인도 중심의 글로벌 임상시험 수행을 위해 현재 추가적인 임상시험 제제를 생산 중이다. 지난 7월에는 유럽 임상시험수탁기관(CRO)의 생산 및 관련 제반 서류에 대한 원격실사(Remote GMP Audit)를 마치고 코로나19 치료제 ES16001의 상용화와 안정적인 공급을 위한 글로벌 생산 기지를 갖추기 위해 준비 중이다.
◎공감언론 뉴시스 [email protected]
Copyright © NEWSIS.COM, 무단 전재 및 재배포 금지