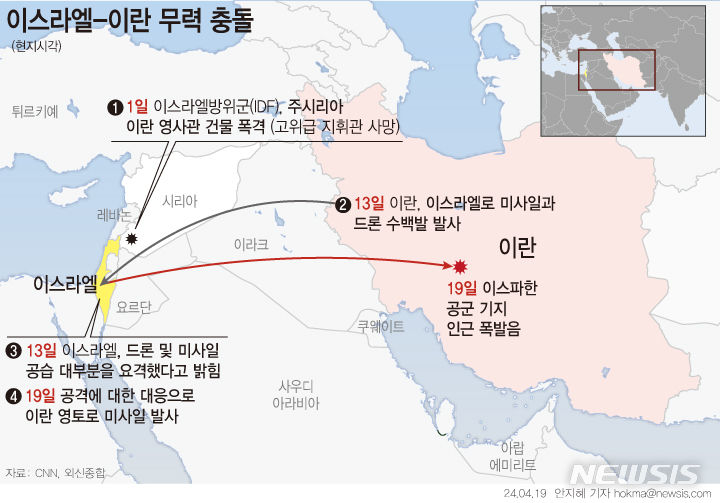
크리스탈지노믹스, 췌장암 신약 美 임상 2상 계획 승인
췌장암 환자 70명 대상 아이발티노스타트와 카페시타빈 병용 투여 요법

(사진=크리스탈지노믹스 제공) *재판매 및 DB 금지
【서울=뉴시스】황재희 기자 = 크리스탈지노믹스는 미국 식품의약국(FDA)으로부터 췌장암 신약 후보물질 ‘아이발티노스타트’의 임상 2상을 위한 시험계획(IND)을 승인받았다고 17일 밝혔다.
췌장암 임상 2상은 1차 표준치료 요법인 폴피리녹스(FOLFIRINOX) 요법을 받은 진행성 또는 전이성 췌장암 환자 중 질병이 진행되지 않은 환자 70명을 대상으로, 아이발티노스타트와 로슈 치료제인 카페시타빈(capecitabine)을 병용 투여한다. 시험군과 대조군으로 카페시타빈 단독 요법과 비교해 암이 진행되지 않는 무진행생존기간(PFS) 및 질병통제율(DCR), 전체생존기간(OS), 안전성 평가 등을 진행한다.
미국 샌프란시스코에 있는 캘리포니아 의과대학(UCSF) 앤드류 고(Andrew Ko, MD) 교수가 총 책임을 맡아 25개 대학병원과 암 센터에서 환자를 모집한다.
크리스탈지노믹스 관계자는 “췌장암 임상 2상의 환자모집을 보다 빠르고 원활히 하기 위해 최대 25개 병원에서 진행할 것”이라며 “객관적 데이터 확보를 최우선 목표로 해 글로벌 제약사 등에 기술이전 가능성을 타진해 췌장암 치료제 시장을 선도해 나가겠다”고 강조했다.
◎공감언론 뉴시스 [email protected]
Copyright © NEWSIS.COM, 무단 전재 및 재배포 금지