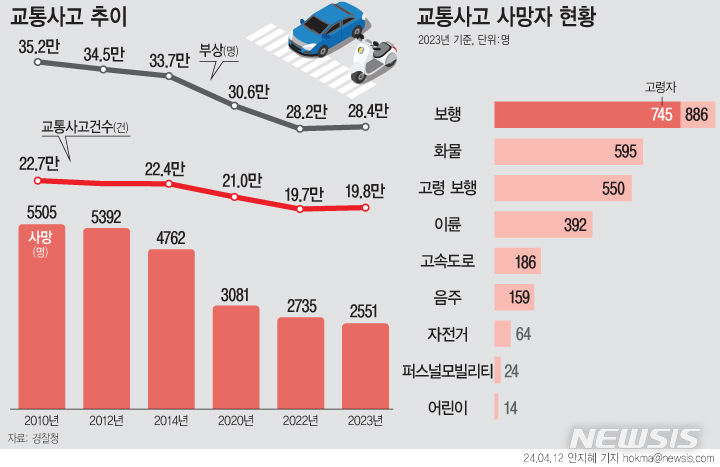
HLB셀, 체내용 지혈제 ‘HLBLS-200’ 임상 변경 승인
식약처 임상시험계획 변경 승인
한양대병원·삼성서울병원 등에서 138명 임상

(사진=HLB 생명과학 제공) *재판매 및 DB 금지
【서울=뉴시스】황재희 기자 = HLB생명과학 자회사 HLB셀은 개발 중인 체내용 지혈제 ‘HLBLS-200’(상품명 BleeFix)이 식품의약품안전처로부터 임상시험계획 변경을 승인받았다고 19일 밝혔다.
이는 작년 8월 임상시험계획 승인 후 대상 환자 수 변경에 따른 재승인이다. HLB셀은 환자수가 조정됨에 따라 당초 임상시험 일정을 앞당길 수 있을 것으로 전망하고 있다.
HLBLS-200은 간 절제술 시 1차 지혈 후 삼출 형태의 출혈이 계속되는 환자에게 사용하기 위한 수술용 지혈제다. 히알루론산, 폴리라이신 등 생체고분자가 주성분인 분말 형태의 지혈제로, 생체적합성이 뛰어나 혈액응고 기전과 상관없이 수분과 접촉 시 10초 이내에 겔(Gel) 형태로 전환돼 주변 조직과 강하게 점착되는 특성을 갖고 있다.
이번 임상은 임상3상에 해당되는 확증 임상시험으로, 동일한 분말 형태의 대조군과 비교해 비열등성을 증명하고, 지혈성능과 안전성을 비교 검증하는 방식으로 진행된다. 한양대병원, 삼성서울병원 등 3개 병원에서 138명의 환자를 대상으로 약 18개월간 진행될 예정이다.
HLB셀 이두훈 대표는 “HLBLS-200은 탐색적 임상시험에서 5분 지혈성공률이 100%를 보이는 등 기존 전분 유래 분말 지혈제들과 비교해 우월한 지혈 특성을 보이고 있다”며 “이번 확증 임상에서 약물의 효능과 경쟁력을 입증하겠다”고 말했다.
한편 연구개발특구진흥재단에 따르면 국내 지혈제 시장은 2018년 3100만 달러(369억원)에서 연평균 8.7% 이상 성장하고 있으며, 2023년에는 4710만 달러(561억원)에 이를 것으로 전망된다.
◎공감언론 뉴시스 [email protected]
Copyright © NEWSIS.COM, 무단 전재 및 재배포 금지