체외진단기기 시장진입 80일로 단축…의료기술 '先허가·後규제'
정부 '의료기기 분야 규제혁신 및 산업육성 방안'
'산병협력단'·연구의사 육성…진료경험 활용↑
내달부터 기술창업펀드 300억원 조성해 지원

【성남=뉴시스】전신 기자 = 문재인 대통령이 19일 경기도 성남 분당서울대병원 헬스케어혁신파크를 방문해 네오팩트의 재활치료용 글러브를 체험하고 있다. 2018.07.19. [email protected]
【세종=뉴시스】임재희 기자 = 정부가 안전성 우려가 적은 의료기술 인·허가 제도를 '사전규제' 방식에서 '사전허용-사후규제' 방식으로 전환하면서 체외진단기기의 시장진입 기간이 390일에서 80일로 대폭 단축된다. 연구결과 축적이 어려운 혁신·첨단 의료기술의 시장진입 문턱도 낮아질 전망이다.
또 산업과 병원간 협력단을 운영하고 연구의사를 육성해 의료기기 개발 생태계를 조성하고 민관 합동 300억원 규모로 기술창업펀드를 조성해 창업을 지원할 계획이다.
정부는 19일 관계부처 합동으로 이런 내용이 담긴 '혁신성장 확산을 위한 의료기기 분야 규제혁신 및 산업육성 방안'을 발표했다.
정부는 의료기기분야 연구개발(R&D)에 2012년 2701억원, 2014년 2943억원, 2016년 3665억원 등 연평균 7.9%씩 투자규모를 늘리고 규제기간을 단축해왔으나 의료기기 분야 산업 기술변화 속도에는 미치지 못했다는 지적을 받았다.
신의료기술이 시장에 진입하려면 식품의약품안전처로부터 의료기기허가(80일)를 받고 건강보험심사평가원의 급여·비급여 대상 여부 확인(30~60일), 보건복지부의 신의료기술평가(280일)를 거쳐 보험급여 등재(100일) 등 최대 520일까지 규제과정을 거쳐야 했다.
이에 정부는 내년 1월부터 기존 사전규제 방식을 '사전허용-사후규제' 형태인 '포괄적 네거티브 규제'로 바꾸기로 했다. 인체 유해성 우려가 적은 분야가 대상이다.
이로써 질병진단 등 목적으로 인체에서 채취한 혈액, 분변 등 검체를 체외에서 검사하는 체외진단검사분야는 시장진입에 걸리는 시간이 390일에서 80일 이내로 5분의 1 수준이 된다. 우선 내년 1월 감염병 관련 체외진단검사 분야부터 시작해 전 분야로 확대할 계획이다.
지금까지 체외진단검사 분야는 시장에 진입하려면 식약처로부터 의료기기 성능과 위해 여부 등을 80일간 검토받은 뒤 심평원의 요양급여 대상여부 판단(30~60일), 복지부의 신의료기술평가(140~250일) 등을 거쳐야 했다.
하지만 내년부턴 식약처가 의료기기 허가만 내주면 심평원과 복지부 평가를 건너 뛸 수 있게 돼 최대 390일이던 시장진입 기간이 80일 이내로 줄어든다. 기존 기기와 비교했을 때 중대한 변경사항이 없다면 식약처의 변경허가도 면제해준다.
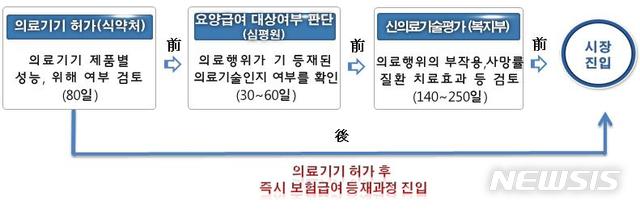
【세종=뉴시스】체외진단분야 '선 진입-후 신의료기술평가' 전환시 의료기기 허가를 받은 기기는 즉시 보험급여 등재과정에 진입해 390일이던 시장진입 기간이 80일 이내로 줄어들 전망이다. 2018.07.19.(그래픽 = 보건복지부 제공)[email protected]
인공지능(AI), 3D 프린팅, 로봇 등을 활용한 미래유망 혁신·첨단의료기술이 최소한의 안전성을 확보한 경우 우선 시장진입을 허용한다. 재평가는 임상현장에서 3~5년간 사용한 후 축적된 임상 근거를 바탕으로 한다.
지금까지 신의료기술평가는 문헌을 중심으로 이뤄지는 까닭에 개발이력이 짧고 연구결과가 부족한 혁신·첨단 의료기술은 탈락할 수밖에 없었다.
이 같은 시장진입 어려움을 해소하기 위해 복지부는 문헌 근거가 부족하더라도 잠재가치를 추가적으로 고려하는 별도 평가트랙을 혁신·첨단 의료기술에 한해 도입한다. 식약처는 의료기기 허가 단계가 개발과 동시에 허가되도록 '신속허가 가이드라인'을 구축한다. 심평원은 '의료진의 편의 및 생산성'을 증진시키는 기술에 예비분류 코드나 확인증을 발급해 시장진입 기간을 줄인다.
여러 규제기관을 거쳐야 했던 인·허가 과정도 절차 간소화와 통합심사 등을 통해 최대 100일까지 단축한다.
규제기간 단축을 위해 우선 신의료기술평가 절차를 280일에서 250일로 30일 단축하고 490일 정도 걸렸던 보험등재심사와 신의료기술평가를 동시에 진행해 이 기간을 100일가량 앞당긴다. 통합심사는 전담팀을 꾸려 창구를 일원화해 중복 자료요청 혼선을 없애기로 했다.
규제정보 등은 규제기관별 누리집과 연동되는 '통합정보포털 시스템' 구축으로 접근하기 쉬워진다. 규제기준, 심의결과 등 규제 진행과정을 공개해 신청인이 심사관에게 제품 특이성을 직접 설명할 수 있고 신의료기술평가 최종 결정 전 의견진술 기회도 주어진다.
이번 정부 발표에는 산업육성 방안도 담겼다.
전국 10개 연구중심병원에는 '산병협력단' 등 병원이 의료기술 특허 사업화와 창업 지원을 전담할 수 있는 자체 조직 설립을 허용해 산업·병원·연구 협력 체계를 구축한다. 연구중심병원은 지정제를 인증제로 전환해 연구역량을 갖춘 병원을 단계적으로 육성할 계획이다.
의사들이 환자 진료경험을 토대로 혁신적 의료기기를 개발할 수 있도록 연구의사 양성체계를 강화한다. 수련 전공의부터 신진·중견의사 등 단계별로 임상 연구의사를 육성한다.
이를위해 복지부와 과학기술정보통신부는 진로시간을 단축해 연구시간을 보장하고 연구 공간·장비, 연구비를 지원받도록 지원한다. 대학 내 임상의사와 기초연구 과학자간 협업연구를 위해 기초의과학 분야 대학원이 설치된 대학 35곳에 지원하는 선도연구센터(MRC, 35개)에 병원 임상의사 30% 이상 참여 등을 의무화한다.
아울러 국산 의료기기 기술개발 경쟁력 제고를 위해 병원 테스트베드 지원 사업을 확대하고 관련부처 협력 의료기기 R&D 사업을 범부처 사업으로 통합한다.
복지부는 '보건산업 초기 기술창업펀드'를 300억원(정부 180억원+민간 120억원) 규모로 조성해 다음달부터 운영한다. 이 가운데 60%는 바이오헬스산업 분야 5년 이내 초기 창업기업에 투자된다.
의료기기 인허가 규제혁신 뿐만 아니라 의료분야 연구개발 및 사업화의 중요한 자원인 의료 데이터 활용을 활성화한다.
법적 체계 마련을 위해 복지부는 '의료기기산업육성법', 식약처는 '체외진단기기법' 제정을 위해 각각 국회와 협력한다.
박능후 복지부 장관은 "이번 대책이 국내 의료기기 산업분야가 성장하고 국내 기업이 세계 시장으로 진출할 수 있는 교두보 역할을 할 것으로 기대한다"며 "연구중심병원내 산병협력단 등이 설립됨으로써 안정적인 연구인력 고용이 가능해져 좋은 일자리도 창출되고 지역 거점병원과 연구중심병원·기업·대학 등과의 공동 연구를 통해 지역의 혁신성장은 물론 지역경제도 활성화될 것"이라고 말했다.
다만 "의료기기 분야는 국민의 생명과 직결되는 분야이므로 국민의 안전을 최우선으로 고려하면서 규제를 혁신해 나갈 것"이라고 덧붙였다.
[email protected]
Copyright © NEWSIS.COM, 무단 전재 및 재배포 금지





















































































































