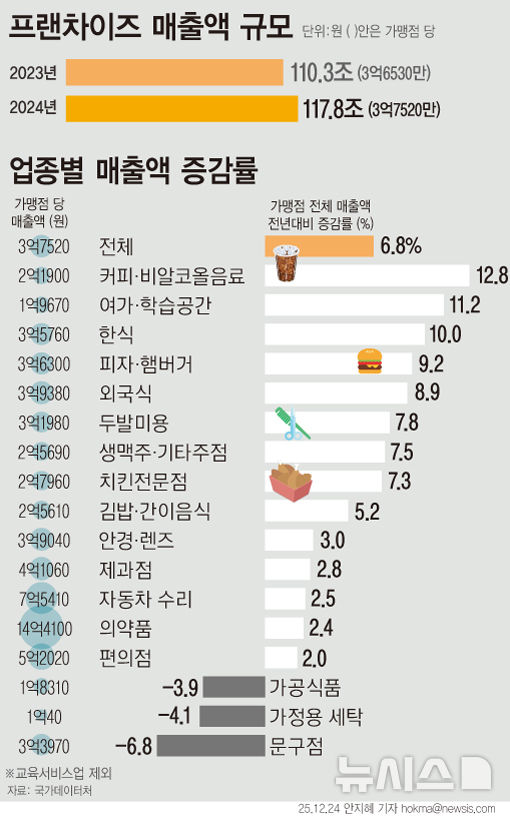
삼성바이오에피스, 희귀질환약 유럽허가 긍정의견 획득
솔리리스 바이오시밀러 '에피스클리'
![[서울=뉴시스] 삼성바이오에피스 사옥 (사진=삼성바이오에피스 제공) *재판매 및 DB 금지](https://img1.newsis.com/2023/04/01/NISI20230401_0001231906_web.jpg?rnd=20230401141354)
[서울=뉴시스] 삼성바이오에피스 사옥 (사진=삼성바이오에피스 제공) *재판매 및 DB 금지
[서울=뉴시스]송연주 기자 = 바이오의약품 개발 기업 삼성바이오에피스는 유럽의약품청(EMA) 산하 약물사용 자문위원회(CHMP)에서 희귀질환 치료제 '솔리리스'의 바이오시밀러(바이오의약품 복제약) '에피스클리'의 판매허가 긍정 의견을 획득했다고 1일 밝혔다.
솔리리스는 미국 알렉시온이 개발한 발작성 야간혈색소뇨증(PNH) 등 난치성 희귀질환 치료제다. 연간 치료 비용이 수 억원에 달하는 고가 바이오의약품이다. 지난 해 연간 글로벌 매출액은 37억6200만 달러(약 4조7000억원)이다.
에피스클리는 삼성바이오에피스가 혈액학 분야에서 첫 번째로 개발한 제품이다. 통상 2~3개월 가량 소요되는 유럽연합 집행위원회(EC)의 최종 검토를 거쳐 공식 판매 허가를 받을 것으로 전망된다.
삼성바이오에피스는 현재 유럽 시장에서 총 6종의 바이오시밀러 제품을 상업화 했다. 에피스클리 허가 권고를 받으며 자가면역∙종양∙안과질환 치료제에 이어 혈액학 분야로 사업 포트폴리오를 보다 다양화할 수 있게 됐다.
삼성바이오에피스 관계자는 “에피스클리는 초고가 바이오의약품의 환자 접근성 개선을 가능하게 함으로써 바이오시밀러 개발의 본질적 의미를 실현시킬 수 있는 의약품이다”며 “희귀질환으로 고통받는 환자들에게 더 많은 치료 기회를 제공할 수 있도록 노력하겠다”고 말했다.
◎공감언론 뉴시스 [email protected]
Copyright © NEWSIS.COM, 무단 전재 및 재배포 금지