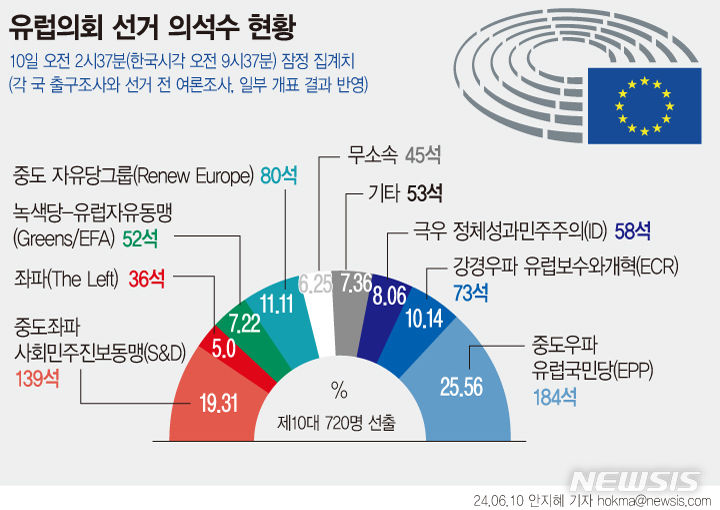
티움바이오 "항암제 'TU2218' 1b상 효과"…美학회 발표
미국 임상종양학회서 중간결과 발표
하반기, 임상 1b상 탑라인 결과 공개
![[서울=뉴시스] 티움바이오 로고 (사진=뉴시스 DB) photo@newsis.com *재판매 및 DB 금지](https://image.newsis.com/2022/06/02/NISI20220602_0001011870_web.jpg?rnd=20220602101030)
[서울=뉴시스] 티움바이오 로고 (사진=뉴시스 DB) [email protected] *재판매 및 DB 금지
[서울=뉴시스]황재희 기자 = 희귀난치성질환 치료제 연구개발 전문기업인 티움바이오가 개발 중인 면역항암제 중간 데이터를 미국 임상종양학회(ASCO)에서 공개한다.
티움바이오는 경구용 면역항암제 ‘TU2218’의 임상 중간결과를 ASCO에서 공개한다고 24일 밝혔다.
TU2218은 체내에서 면역항암제 활성을 방해하는 ‘형질전환성장인자’(TGF-ß)와 ‘혈관내피생성인자’(VEGF)의 경로를 동시에 차단해 ‘키트루다’와 같은 면역항암제 효능을 극대화하는 계열내 최초 이중 저해제(dual inhibitor)다.
티움바이오는 현재 미국에서 TU2218과 키트루다 병용투여 임상 1b상을 진행 중으로, ASCO에서 공개한 초록에는 임상 1b상 환자 중 12명까지의 중간결과가 담겨있다.
임상 1b상은 TU2218 용량에 따라 총 3개의 투약그룹(52.5㎎, 75㎎, 97.5㎎)으로 나뉘었다. 임상에 참여한 환자들은 사이클별로 TU2218을 하루 두 번 2주간 경구 복용 후 1주간 휴식기를 갖는다. 이와 함께 키트루다 200㎎을 3주에 한 번 정맥 투여하며 병용투약의 안전성과 효능 등을 검증하는 임상이다.
티움바이오에 따르면, 임상시험 중간결과에서 임상에 참여한 진행성 말기 고형암 환자 12명 중 암이 부분적으로 사라진 상태인 부분관해(PR) 2명, 종양 크기에 변화가 없는 안정병변(SD) 6명으로, 질병통제율(DCR) 66.7%의 결과를 보였다.
질병통제율이란 임상시험에서 치료를 받은 환자 중 질병이 진행되지 않거나 질병이 진행되더라도 질병의 진행을 늦추거나 완화해 환자의 생존을 연장할 수 있는 치료의 효과를 나타내는 지표를 말한다.
또 임상 1b상에서 최고용량 투약그룹(195㎎/day)까지 용량을 제한하는 독성(DLT)이 발견되지 않았고, 최대내약용량(MTD)에도 도달하지 않아 내약성과 안전성을 보였다.
김훈택 티움바이오 대표는 “진행성 고형암 환자들을 대상으로 진행하고 있는 임상 1b상에서 질병통제율 66%가 넘는 결과를 중간결과로 도출했다”며 “임상 2상의 권장용량인 하루 195㎎ 투약 환자들에서 고무적인 반응을 확인하고 있어 TU2218에 대한 기대를 높이고 있다”고 말했다.
한편 ASCO는 세계 3대 암 학회 중 하나로, 매년 의료 관계자, 과학자, 다국적 제약사 및 바이오 기업 등이 다수 참석해 암 분야의 최신 연구 성과와 항암제 임상 데이터 등을 발표하고 있다. 오는 31일부터 6월 4일(현지시간)까지 미국 시카고에서 개최된다.
◎공감언론 뉴시스 [email protected]
Copyright © NEWSIS.COM, 무단 전재 및 재배포 금지