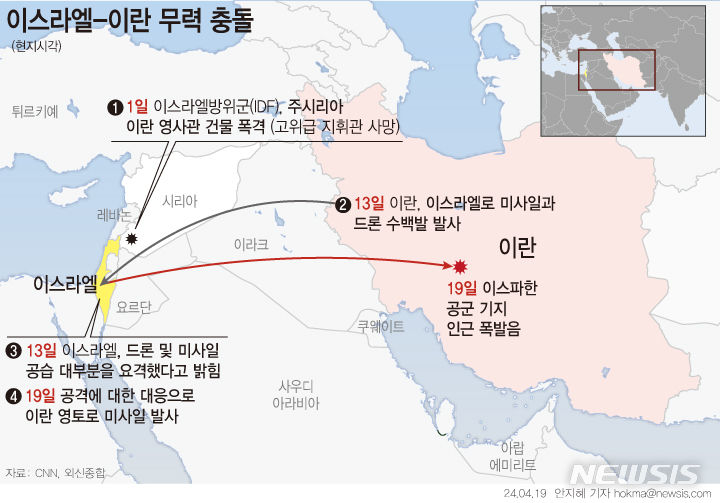
뉴지랩파마 자회사, 폐암 치료제 '탈레트렉티닙' 임상 2상 순항

[서울=뉴시스] 김경택 기자 = 뉴지랩파마 신약 개발 전문 자회사 뉴지랩테라퓨틱스는 비소세포성 폐암 치료제 '탈레트렉티닙'의 국내 임상 2상을 순조롭게 진행하고 있다고 26일 밝혔다. 뉴지랩테라퓨틱스는 지난해 말 탈레트렉티닙의 첫 환자 등록에 이어, 최근 두 번째 환자까지 등록해 투약을 진행 중이다.
회사 측에 따르면 뉴지랩테라퓨틱스는 지난해 9월 식품의약품안전처로부터 탈레트렉티닙에 대한 국내 임상 2상 승인을 받았다. 서울아산병원에서 국내 첫 환자와 두 번째 환자까지 등록을 마쳤으며, 고려대병원, 부산대병원, 화순 전남대병원 등 총 5곳으로 임상병원을 확대해 가고 있다.
탈레트렉티닙은 비소세포성 폐암을 비롯해 다양한 고형암종에서 발견되는 'ROS-1' 및 '티로신수용체키나제(NTRK) 유전자 융합 변이 단백질'의 활성화를 차단, 억제해 암전이를 막고 소멸시키는 기전을 보유한 항암 신약물질이다.
탈레트렉티닙은 글로벌 임상 1상 과정에서 암이 완전히 소멸된 완전관해 사례와 혈뇌장벽(BBB)을 통과해 전이된 뇌암을 억제하는 효과가 확인된 바 있다. 또 중국 임상 2상에서 객관적 반응률(ORR)이 치료 경험이 없는 환자군에서 90.5%, 잴코리 내성이 생긴 환자군 대상으로 43.8%로 확인됐다.
이는 화이자의 '잴코리(Xalkori)'가 미국 식품의약국(FDA) 승인 당시 기록한 객관적 반응률(72%)보다 우수한 결과다. 이러한 임상시험 결과로 볼 때 탈레트렉티닙은 비소세포성폐암의 표준 치료제인 잴코리에 내성이 생긴 환자들에게 충분한 대안이 될 수 있을 전망이라고 회사 측은 설명했다.
뉴지랩파마 관계자는 "탈레트렉티닙은 글로벌 임상 1상 및 2상에서 성공적인 결과가 나온 만큼 국내 임상2상도 성공할 것으로 본다"며 "국내 임상2상 종료 후 희귀약품 지정제도를 활용해 빠르게 상업화를 진행할 예정"이라고 말했다
탈레트렉티닙은 국내를 비롯해 미국, 일본, 중국 등에서 글로벌 임상 2상을 동시에 진행되고 있다.
◎공감언론 뉴시스 [email protected]
Copyright © NEWSIS.COM, 무단 전재 및 재배포 금지