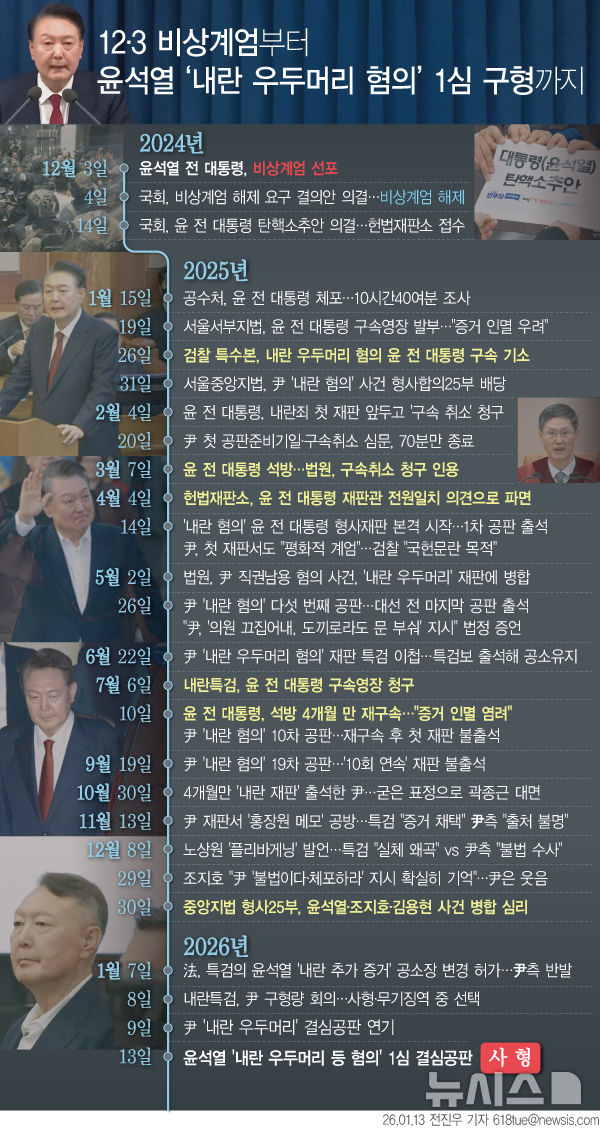
HK이노엔 "신약 케이캡, 美3상 성공적…4분기 허가신청"
파트너사 세벨라, 3상 톱 라인 발표
"EE 및 NERD 모두 1·2차 지표 충족"
![[서울=뉴시스] HK이노엔 위식도역류질환 신약 '케이캡' 제품군. (사진=뉴시스 DB) photo@newsis.com *재판매 및 DB 금지](https://img1.newsis.com/2024/04/23/NISI20240423_0001533065_web.jpg?rnd=20240423095819)
[서울=뉴시스] HK이노엔 위식도역류질환 신약 '케이캡' 제품군. (사진=뉴시스 DB) [email protected] *재판매 및 DB 금지
[서울=뉴시스]송연주 기자 = 제약바이오 기업 HK이노엔은 위식도 역류질환 신약 '케이캡'(성분명 테고프라잔)의 미국 3상 임상시험 결과, 케이캡이 미란성 식도염 및 비미란성 위식도 역류질환 임상 모두에서 1차, 2차 평가지표를 충족했다고 24일 밝혔다.
이날 HK이노엔에 따르면 미국 파트너사 세벨라는 23일(현지 시간) 위식도 역류질환 환자를 대상으로 케이캡을 평가한 2건의 미국 3상(TRIUMpH)의 주요 결과(톱라인)를 발표했다.
케이캡은 HK이노엔이 개발한 대한민국 30호 신약으로, P-CAB(칼륨 경쟁적 위산분비 억제제) 계열이다. 지난 2021년 HK이노엔은 미국 세벨라에 케이캡을 기술 이전해, 이번 임상은 세벨라의 소화기의약품 전문 계열사 브레인트리가 진행했다. 미란성 식도염(EE)과 비미란성 위식도 역류질환(NERD) 환자를 대상으로 했다.
미란성 식도염 및 비미란성 위식도 역류질환 임상 결과, 테고프라잔은 1차 및 2차 평가지표 모두 충족했다.
미란성 식도염 임상에서는 미란성 식도염 전체 환자군과 중등도 이상의 식도염(LA 등급 C, D) 환자군 모두의 2주 및 8주차 치유율에서 PPI(란소프라졸) 대비 통계적 우월성을 입증했다.
비미란성 위식도 역류질환 임상시험에서 테고프라잔은 가슴 쓰림(야간 및 가슴 쓰림 없는 날)과 위산 역류 모두에서 완전한 증상 개선 효과가 나타났다.
연구에서 발생한 개별 이상반응은 3% 미만으로 대부분 경미하고 일시적인 수준이었다고 설명했다. 심각한 이상반응 발생률은 2% 미만으로, 테고프라잔, PPI, 위약 그룹 간에 유의한 차이를 보이지 않았다.
세벨라는 이번 임상시험 외에 추가로 진행 중인 '미란성 식도염 치료의 유지요법' 3상을 올해 3분기에 마칠 예정이다. 올해 4분기에는 미국 FDA에 미란성 식도염 및 비미란성 위식도 역류질환 적응증을 포함한 신약허가신청(NDA)을 제출할 계획이다. 세벨라는 이번 TRIUMpH 연구 결과를 권위 있는 학술지에 투고하고, 주요 소화기학회에서 발표할 예정이다.
세벨라 파마슈티컬스의 앨런 쿡 사장은 "테고프라잔이 미란성 식도염 및 비미란성 위식도 역류질환 임상시험에서 1차 및 2차 평가지표를 모두 달성해 기쁘다"며 "특히 미란성 식도염에서는 란소프라졸 대비 2주 및 8주 치료 모두에서 우수한 치유 효과를 보인 점이 고무적"이라고 말했다.
와일 코넬 의과대학 임상 의학 교수이자 제이 모나한(Jay Monahan) 소화기 센터장인 펠리스 슈놀-서스먼 박사는 "테고프라잔의 미란성 식도염 데이터는 P-CAB 계열이 PPI보다 우수한 효과를 나타낼 수 있음을 보여주며 테고프라잔이 다른 약제에 비해 이점을 제공할 수 있음을 시사한다"고 말했다.
HK이노엔 곽달원 대표는 "대한민국이 개발한 신약 케이캡이 세계 최대 의약품 시장인 미국에서 성공적으로 3상 임상시험을 마쳐 뜻깊다"고 말했다.
◎공감언론 뉴시스 [email protected]
Copyright © NEWSIS.COM, 무단 전재 및 재배포 금지