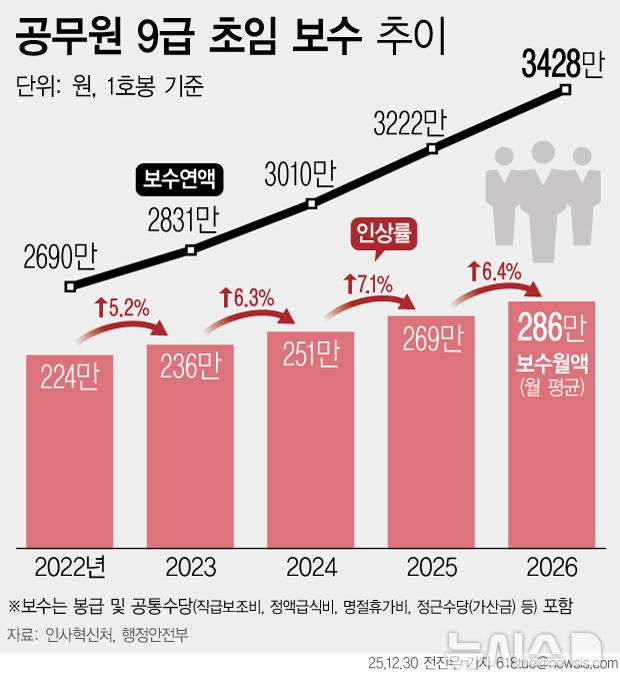
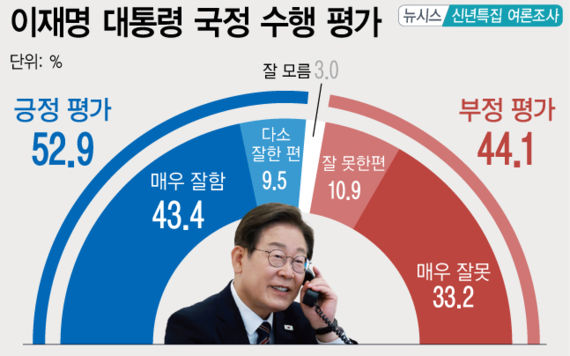
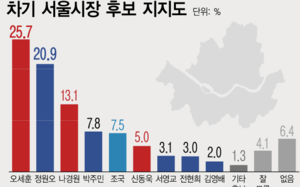
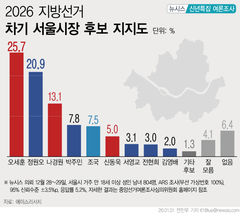
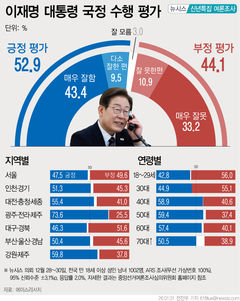
지아이이노 "美FDA, 면역항암제 추가 코호트 임상 승인"
MSD, '키트루다' 무상 제공 확대

(사진=지아이이노베이션 제공) *재판매 및 DB 금지
[서울=뉴시스]송연주 기자 = 바이오 기업 지아이이노베이션은 새로운 제조공정을 도입한 면역항암제 ‘GI-101’의 1·2상 임상시험의 추가파트인 파트 E, F의 계획(IND)에 대해 미국 식품의약국(FDA) 승인받았다고 31일 밝혔다.
GI-101은 ‘CD80’과 ‘IL-2’ 변이체의 기능을 동시에 가진 이중융합단백질이다. 단일 면역관문억제제 또는 IL-2(인터루킨-2) 제제의 단점을 극복하도록 설계됐다.
GI-101 임상의 1·2상 결과는 유럽종양학회(ESMO)에서 공개될 예정이다.
이번 새로운 제조 공정을 도입한 GI-101은 원숭이 모델에서 항암면역세포 수의 증식을 기저치(투여 전) 대비 7배 이상 높였다고 회사는 설명했다.
지아이이노베이션은 공동 임상 파트너사 미국 MSD와 논의해 병용 시너지가 예상되는 암종으로 새 전략을 수립했다. 이번에 포함된 고형암에는 MSS 대장암, 두경부암, 메르켈세포암 등이 있다.
MSD는 GI-101의 임상시험 설계 변경에 대한 승인과 함께 ‘키트루다’ 무상 공급을 추가로 확대 지원하기로 했다.
지아이이노베이션 장명호 CSO는 “키트루다와 병용요법을 통해 국내·외 가속승인을 포함한 빠른 상업화가 가능하도록 노력하겠다”고 말했다.
◎공감언론 뉴시스 [email protected]
Copyright © NEWSIS.COM, 무단 전재 및 재배포 금지