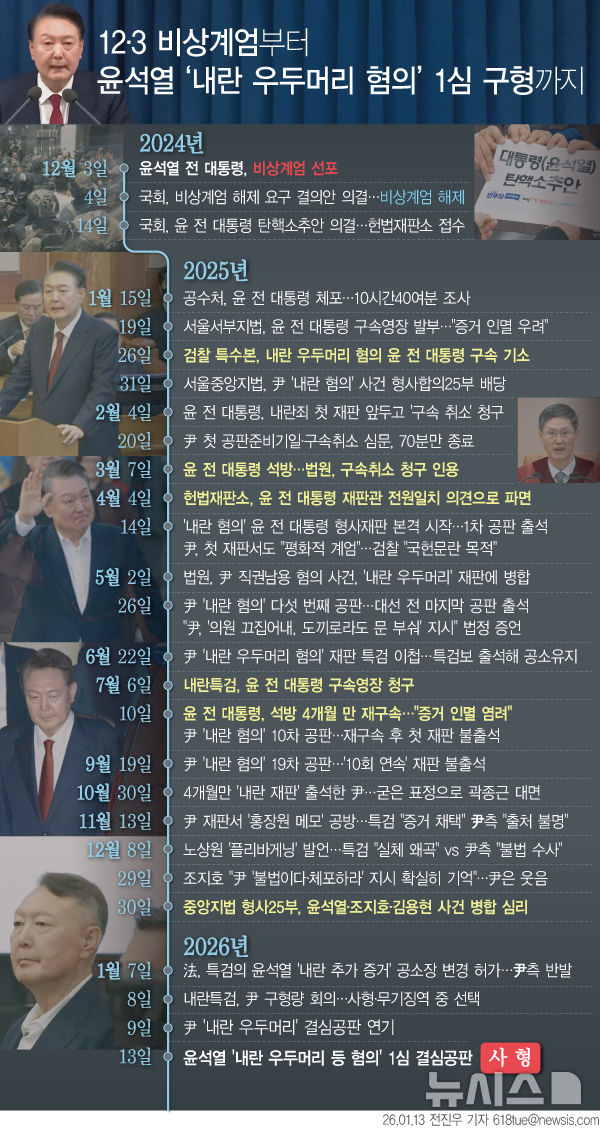
에스티큐브 "폐암 면역항암제, 임상 1b·2상 식약처 승인"
소세포폐암 환자 대상 병용 연구
![[서울=뉴시스] 에스티큐브 로고. (사진=에스티큐브 제공) 2023.09.08. photo@newsis.com *재판매 및 DB 금지](https://img1.newsis.com/2023/09/08/NISI20230908_0001360214_web.jpg?rnd=20230908140428)
[서울=뉴시스] 에스티큐브 로고. (사진=에스티큐브 제공) 2023.09.08. [email protected] *재판매 및 DB 금지
[서울=뉴시스]송연주 기자 = 바이오 기업 에스티큐브는 식품의약품안전처로부터 소세포폐암 면역항암제로 개발 중인 '넬마스토바트'(hSTC810) 임상 1b∙2상 시험계획(IND)이 승인받았다고 21일 밝혔다.
재발성 또는 불응성 소세포폐암 환자를 대상으로 기존 화학항암제 '파클리탁셀'에 넬마스토바트를 더한 병용 치료 후 효과·안전성을 알아보는 연구다.
미국 식품의약국(FDA) 임상 1b∙2상 IND 승인 절차도 진행 중이라고 했다.
국내 임상은 삼성서울병원, 서울대병원, 서울대분당병원, 아산병원, 고대안암병원, 가톨릭대성빈센트병원에서, 미국 임상은 엠디앤더슨암센터, 예일암센터, 노스웨스턴대학병원, 조지타운대학교 롬바디암센터에서 진행할 계획이다.
에스티큐브는 임상 1상 데이터에서 파악된 신약의 작용기전과 의료 수요 높은 소세포폐암의 시장 상황을 고려해 적응증을 택했다고 했다.
에스티큐브 관계자는 "병용 치료제가 화학항암제에 저항성을 가진 암세포에서 대조군 대비 높은 효능을 나타낼 것으로 기대한다"고 말했다.
◎공감언론 뉴시스 [email protected]
Copyright © NEWSIS.COM, 무단 전재 및 재배포 금지