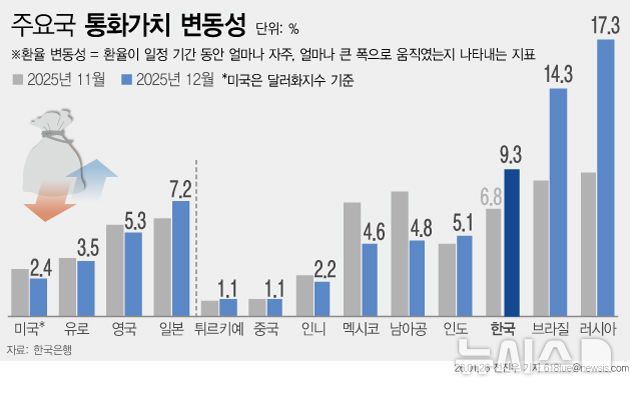
HLB "간암 신약 병용 요법, 美 FDA에 허가 재신청 완료"
"보완 요구사항 반영해 재제출"
![[서울=뉴시스] HLB 로고. (사진=HLB 제공) 2025.09.17. photo@newsis.com *재판매 및 DB 금지](https://img1.newsis.com/2025/09/17/NISI20250917_0001946306_web.jpg?rnd=20250917171307)
[서울=뉴시스] HLB 로고. (사진=HLB 제공) 2025.09.17. [email protected] *재판매 및 DB 금지
[서울=뉴시스]송연주 기자 = HLB는 미국 자회사 엘레바 테라퓨틱스와 중국 파트너사 항서제약이 지난 23일(현지 시간) 미국 식품의약국(FDA)에 간암 신약 허가 재신청을 완료했다고 26일 밝혔다.
같은 날 엘레바는 혈관내피세포성장인자수용체(VEGFR) 티로신 키나제 억제제(TKI) '리보세라닙'에 대한 신약 허가신청(NDA)을, 항서제약은 항 PD-1 항체인 '캄렐리주맙'에 대한 생물의약품허가신청(BLA)을 각 제출했다.
두 약물은 병용요법으로 임상이 진행됐기에, FDA는 이를 하나의 치료제로 간주해 통합 심사를 진행한다.
앞서 캄렐리주맙에 대한 CMC(제조·품질관리) 결함으로 FDA로부터 보완요청서(CRL)를 받아 허가 불발된 바 있다.
이번 재신청은 이전 심사 과정에서 제시된 보완 요구사항을 충분히 반영해 진행됐다고 HLB는 말했다.
리보세라닙·캄렐리주맙 병용요법은 글로벌 임상 3상에서 절제 불가능한 간세포암 환자를 대상으로 전체생존기간 중앙값 23.8개월을 기록하며, 현 간암 1차 치료제 가운데 가장 긴 생존기간을 보인 바 있다. 최종 임상 데이터는 지난해 국제 학술지 란셋 온콜로지(The Lancet Oncology)에 게재됐다.
HLB 측은 "이전 심사 과정에서 제시된 지적사항을 충실히 보완하는 한편, 제출 자료 전반을 다시 점검하고 정비해 재신청을 진행했다"며 "향후 심사 절차 전반에 대해 면밀히 검토해 대응하고, FDA와의 소통에도 성실히 임해 회사가 기대하는 성과로 이어질 수 있도록 최선을 다하겠다"고 말했다.
◎공감언론 뉴시스 [email protected]
Copyright © NEWSIS.COM, 무단 전재 및 재배포 금지