FDA, 마약금단현상의 첫 비마약성 치료제 '루세미라' 승인
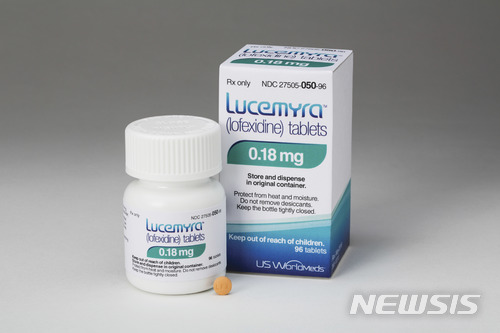
FDA가 승인 사실을 발표한 이 약품은 유에스월드메드(US WorldMeds LLC)사의 루세미라(Lucemyra)로, 지난 3월 열린 FDA 자문위원회에서 승인 권고와 함게 신속심사 대상 지위를 부여 받은 바 있다.
하지만 FDA는 루세미라가 마약성 진통제 사용장애 전용 치료제는 아니며 더 포괄적, 장기적 치료 계획의 일부로 최장 14일 동안 마약성진통제 금단 현상 치료에 사용될 수 있다고 밝혔다.
마약성 약품 금단 현상에는 불안, 초조, 수면장애, 근육통, 콧물, 발한, 구역질과 구토, 설사, 약물에 대한 갈증 등이 포함되어 있다. 보통은 마약류에 의존해 온 환자나 일반 환자 중 마약성 진통제 처방약 등 관련 약품의 사용을 줄이거나 끊었을 때 나타난다.,
루세미라의 안전성과 효능은 그 동안 금단현상을 보였던 약물 의존성을 가진 866명의 성인들을 대상으로 임상실험이 진행되었으며, 플래시보 효과 여부를 가리는 블라인드 테스트를 포함한 두 번의 실험을 통해 입증이 되었다.
미국 질병통제 예방센터 자료에 따르면 미국에서 헤로인, 펜타닐 등 마약성 약품 중독으로 사망한 사람은 2016년 4만2000명에 이르러 사상 최대의 연간 사망자 수를 기록했다.
[email protected]
Copyright © NEWSIS.COM, 무단 전재 및 재배포 금지